臨床研究の審査申請区分について
臨床研究管理センターは、倫理審査委員会、臨床研究審査委員会、医薬品受託研究審査委員会の事務局を担当しております。下図「医学系研究の分類と審査区分」にあるとおり、それぞれの法律や指針に基づき適正に研究を進められるよう、助言や研究支援、申請の受付等を行っております。
臨床研究を実施しようとする研究者は、区分に従い各種委員会へ申請の手続きを行ってください。
なお、特定臨床研究についてはこちらをご確認ください。
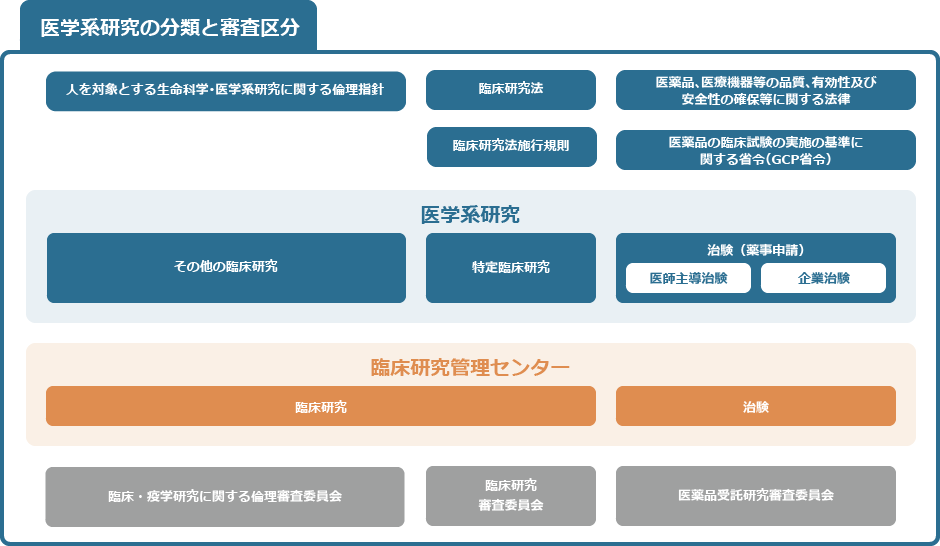
「医学系研究」には、医学に関する研究とともに、歯学、薬学、看護学、リハビリテーション学、予防医学、健康科学に関する研究が含まれます。
倫理審査は、「侵襲」と「介入」の有無によって求められる手続きが異なります。申請に際して、申請区分が不明な場合や軽微な侵襲にあたるかどうか等判断に迷う場合は当センターにご相談ください。

言葉の定義(「人を対象とする生命科学・医学系研究に関する倫理指針」より)
侵襲
研究目的で行われる、穿せん刺、切開、薬物投与、放射線照射、心的外傷に触れる質問 等によって、研究対象者の身体又は精神に傷害又は負担が生じることをいう。 侵襲のうち、研究対象者の身体及び精神に生じる傷害及び負担が小さいものを「軽 微な侵襲」※という。
介入
研究目的で、人の健康に関する様々な事象に影響を与える要因(健康の保持増進に つながる行動及び医療における傷病の予防、診断又は治療のための投薬、検査等を含 む。)の有無又は程度を制御する行為(通常の診療を超える医療行為であって、研究 目的で実施するものを含む。)をいう。
※軽微な侵襲:日常生活や日常的な医学検査で受けるものをいいます。例:健康診断の採血、精神的苦痛を含む内容であることをあらかじめ明示してある質問紙。
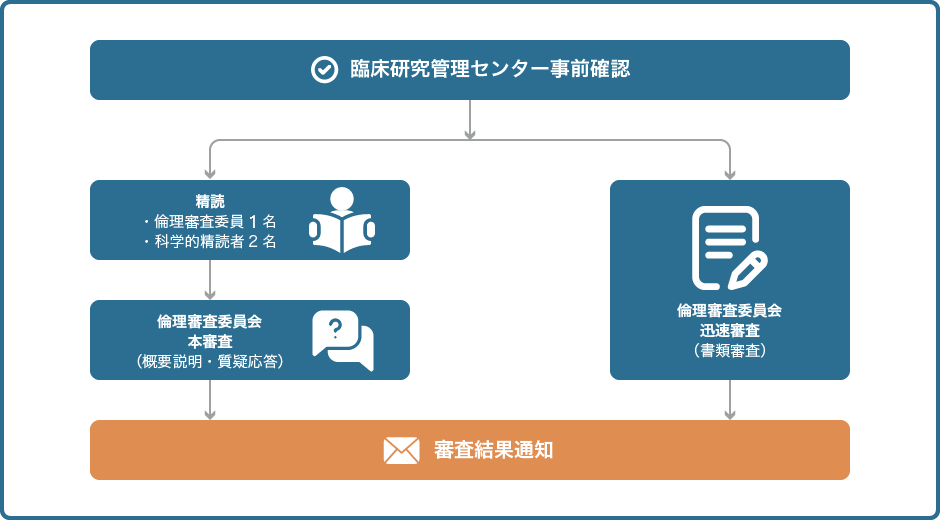
倫理審査申請の手順について
当センターで倫理審査申請書の事前確認をします。倫理審査委員会は原則として月1回です。申請者は余裕を持って申請するようにしてください。倫理審査委員会の詳細はこちら。
臨床研究の開始
臨床研究審査委員会への申請について
臨床研究の申請には倫理審査申請システムを利用して必要書類を添付して申請してください。 各申請に必要な書式は倫理審査申請システムよりダウンロードしてください。
| 1.倫理審査申請書 | システム入力 |
| 2.研究計画書(多施設共同研究の場合は研究代表機関により作成されたもの) | 必要なものを添付 |
| 3.説明同意文書または情報公開文書 | |
| 4.臨床研究利益相反(概略)自己申告書または臨床研究利益相反(詳細)自己申告書 | |
| 5.研究代表機関における倫理審査承認文書(多施設共同研究の場合) | |
| 6.健康被害補償保険契約書または見積書写し(補償保険加入を要する場合) | |
| 7.モニタリング計画書及びモニター指名書(必要時) | |
| 8.監査計画書(必要時) |
臨床研究実施に係る各種手順書はこちら
UMIN-CTRへの登録について
介入を行う臨床研究では、研究開始に先立ちUMIN臨床試験登録システム(UMIN-CTR) に研究内容を登録する必要があります。 UMIN-CTRにおける「IRB等連絡先」には下記を記載してください。
IRB等連絡先
組織名:富山大学臨床・疫学研究等に関する倫理審査委員会
住 所:富山市杉谷2630
電 話:076-415-8857
E-mail:rinri@adm.u-toyama.ac.jp
臨床研究に係る補償保険について
侵襲(軽微な侵襲を除く)を伴う臨床研究であって、通常の診療を超える医療行為を伴う臨床研究を実施する場合は、研究対象者に生じた健康被害に対する補償を行うために保険へ加入する必要があります。手続きに関しましては、臨床研究管理センター(内線8857)にご連絡ください。
試験中
モニタリングと監査
重篤な有害事象報告
終了後
試験の終了報告
臨床研究の実施に係る各種手順書
ここでは臨床研究実施の際に適用される各種手順書をご覧いただけます。
なお、申請様式等の各書式は富山大学デスクネッツネオ学内限定
または、倫理審査申請システム(人を対象とした研究倫理室)の申請メニューよりダウンロードしてください。



