この法律は、研究の不正を防止し、臨床研究に対する国民の信頼確保を通じて、その研究の実施を推進することを目的として平成30年4月1日に施行されました。
臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の制度等を定めています。
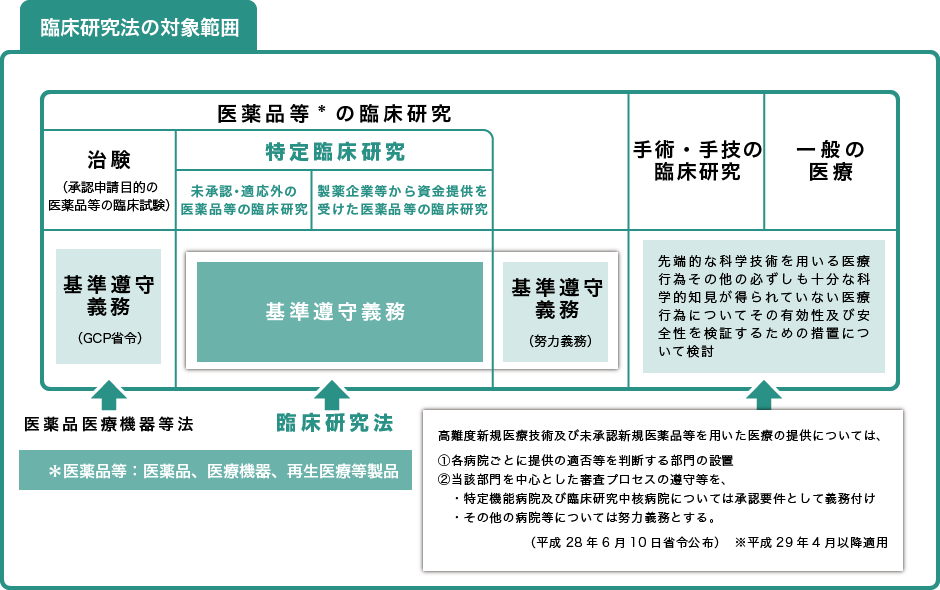
特定臨床研究※にモニタリングや監査を義務付けるほか、違反した場合は、研究中止命令や懲役か罰金といった罰則規定があります。
※特定臨床研究
・製薬企業からの資金提供を受けて実施される臨床研究(第二条2項1号)
・未承認・適応外の医薬品等を用いる臨床研究(第二条2項2号)
臨床研究実施基準
臨床研究(特定臨床研究を除く。)を実施する者は、臨床研究実施基準に従ってこれを実施するよう努めなければならない。(第四条1項)
特定臨床研究を実施する者は、臨床研究実施基準に従ってこれを実施しなければならない。(第四条2項)
- 実施計画を作成し厚生労働大臣に提出すること
- 実施計画の遵守
- 特定臨床研究の対象者等に説明を行い、同意を得ること
- 個人情報の保護
- 認定臨床研究審査委員会への疾病等の報告 など
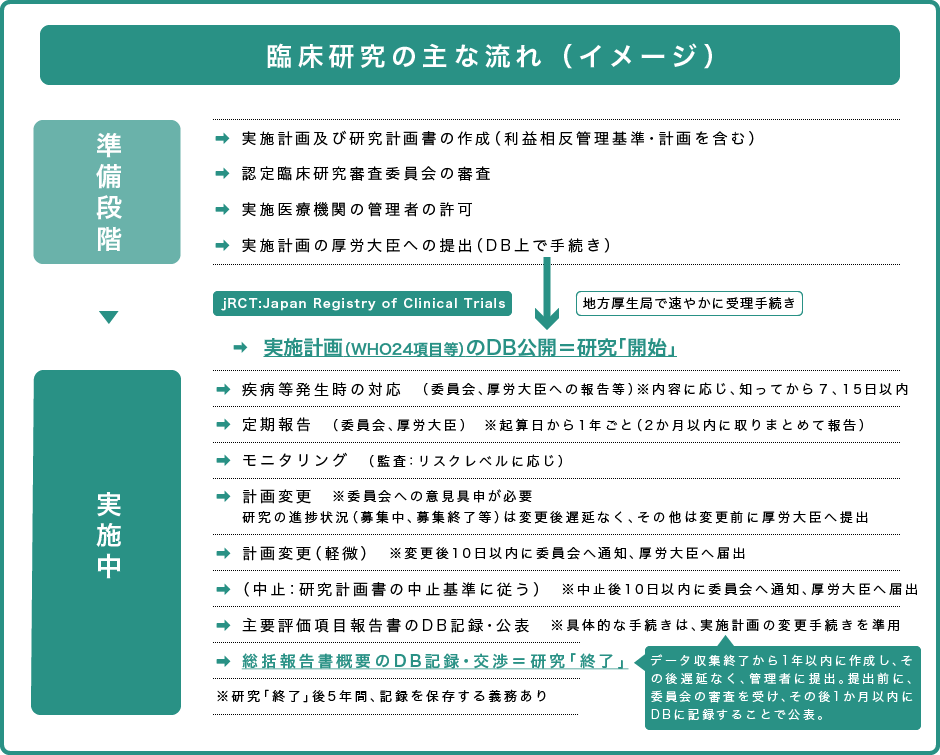
実施計画の届け出
特定臨床研究を実施する者は、実施計画を認定臨床研究審査委員会にかけ、審査を受けたうえで厚生労働大臣に提出し、実施状況や疾病等を報告する必要があります。
研究資金の提供に関する規制
製薬企業からの資金提供を受けて実施される特定臨床研究については、当該研究資金等の額及び内容、当該特定臨床研究の内容その他厚生労働省令で定める事項を定める契約を締結しなければなりません。
また、製薬企業は、研究資金等の提供に関する情報を公表することが求められています。
罰則規定(例)
厚生労働大臣の当該特定臨床研究の停止等の緊急命令(法第十九条)に違反した者
⇒三年以下の懲役もしくは三百万円以下の罰金
当該特定臨床研究で知り得た研究対象者の秘密保持義務に違反して秘密を漏らした者
⇒一年以下の懲役又は百万円以下の罰金
正当な理由なく実施計画を提出せず、又はこれに記載すべき事項を記載せず、若しくは虚偽の記載をしてこれを提出して、特定臨床研究を実施した者
⇒五十万円以下の罰金

